Qu’est-ce que l’alpha-1 antitrypsine ?1,2
L’alpha-1 antitrypsine (AAT) est une protéine du sang sécrétée essentiellement par le foie.
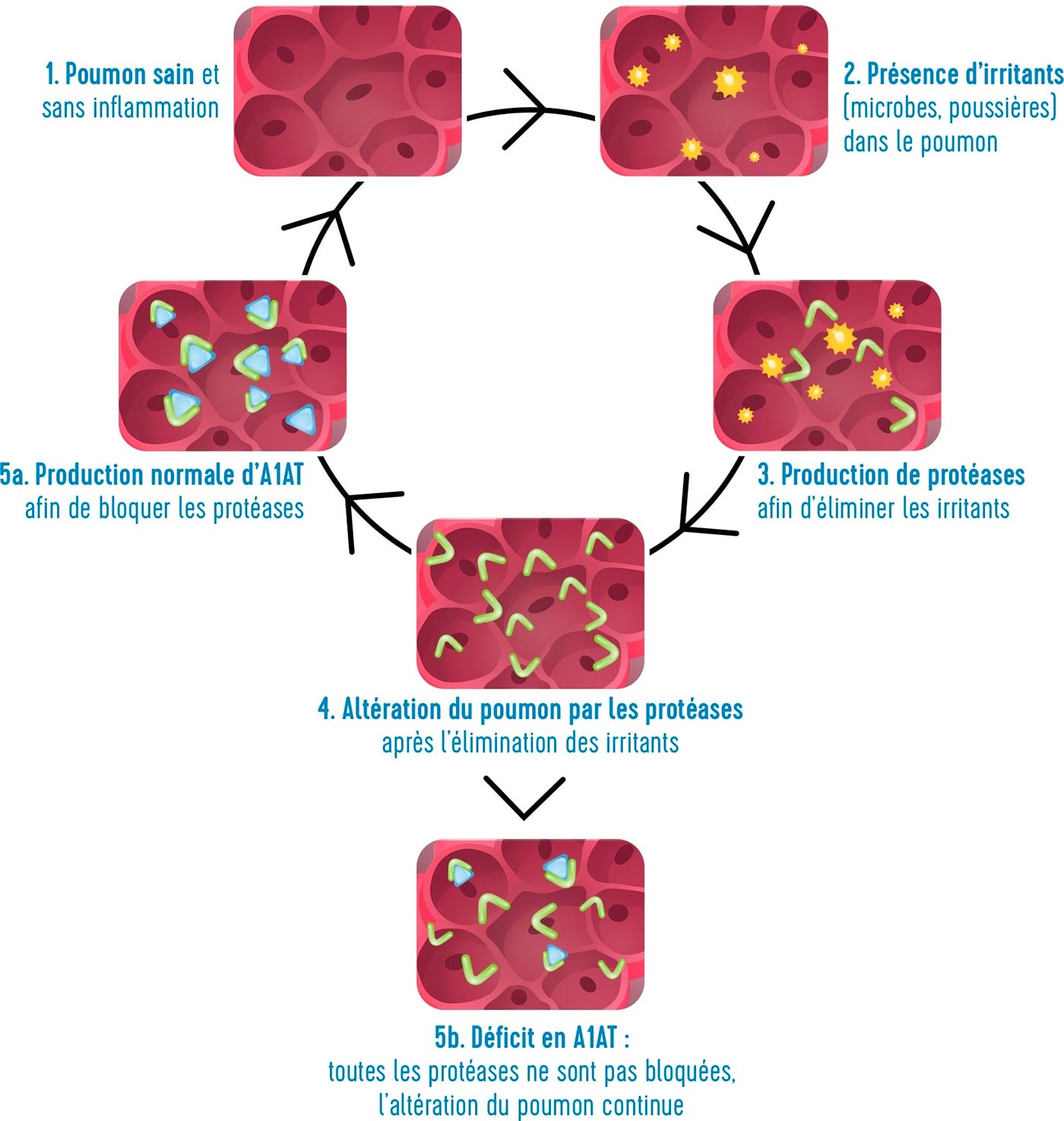
Elle a un rôle de protection des poumons, par exemple lors d’une infection pulmonaire. En effet, lorsque les poumons sont exposés à des facteurs extérieurs (fumée de tabac, polluants, microbes, etc.), l’organisme libère des protéases pour les éliminer. En agissant, ces protéases attaquent également certaines structures fragiles des poumons.
L’alpha-1 antitrypsine est une « anti-protéase », c’est-à-dire qu’elle limite l’action nocive de ces protéases.
A l’état normal, les quantités de protéases et d’alpha-1 antitrypsine s’équilibrent : ceci permet de protéger les poumons contre les agressions microbiennes (rôle des protéases) tout en préservant les fragiles alvéoles pulmonaires des agressions (rôle de l’AAT).
Rôle de l’alpha-1 antitrypsine
les poumons répondent mal aux agressions extérieures.
LE DAAT : UNE MALADIE GÉNÉTIQUE
Comprendre la génétique
Tout ce qui nous définit (couleur des yeux et des cheveux, taille, groupe sanguin, etc.) est déterminé par nos gènes. Pour chaque gène il peut exister plusieurs variants, aussi appelés allèles, qui proviennent de changements (ou mutations). Dans le génome d’un individu, chaque gène existe en 2 copies.
Chacune des copies provient d’un des parents.
En fonction des allèles transmis par les parents, plusieurs combinaisons (ou génotypes) sont possibles pour un gène donné.
•
On distingue 2 grandes catégories
Les 2 allèles sont identiques
C’est-à-dire que l’individu possède 2 copies de la même version du gène. On dit qu’il est homozygote.
Les 2 allèles sont différents
L’individu est hétérozygote. Il possède 2 versions différentes du gène.
Le plus souvent, les gènes permettent à l’organisme de produire des protéines :
ils déterminent le type de protéine, sa structure, sa fonction, etc. En conséquence,
les mutations (changements) du gène peuvent conduire à des anomalies dans la protéine.
L’alpha-1 antitrypsine est produite par un gène situé sur le chromosome 14. Dans le déficit en alpha-1 antitrypsine (DAAT), ce gène est muté et produit des protéines qui fonctionnent mal ou pas du tout.
Il existe plusieurs allèles pour le gène de l’alpha-1 antitrypsine. Ils sont toujours écrits « Pi » suivis d’une lettre distinctive. Les plus fréquemment retrouvés sont 1,2 :
PiM : protéine fonctionnelle, taux normal d’AAT
PiS : protéine souvent légèrement dysfonctionnelle (sa fonction est légèrement endommagée)
PiZ : protéine souvent très dysfonctionnelle (sa fonction est très endommagée)
Pi(null) : pas de protéine produite
PiMMalton : similaire au variant Z, protéine endommagée
Un individu hétérozygote possède 2 allèles différents, par exemple PiMZ.
Un individu homozygote possède 2 allèles identiques, par exemple PiZZ.
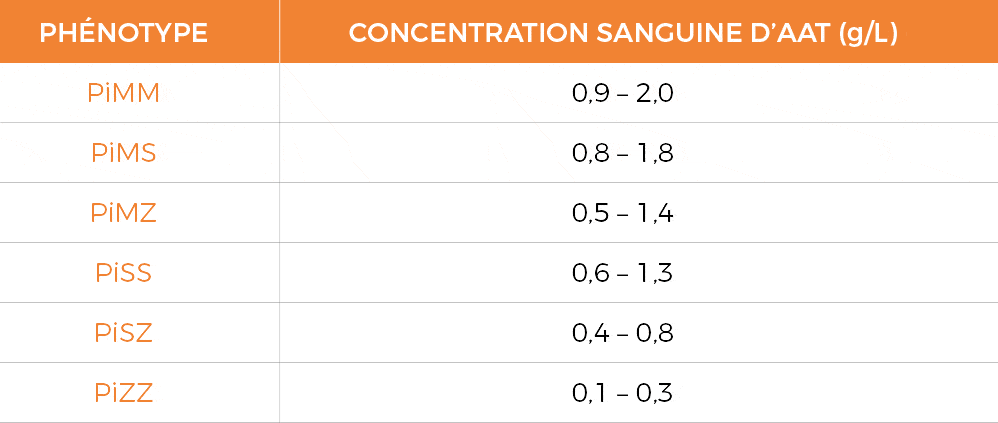
Tableau des différentes combinaisons alléliques (phénotype) et de la sévérité du déficit associée1,2

Le tableau ci-dessus récapitule les différentves combinaisons et la concentration en AAT qui correspond.
Le taux sanguin normal de l’AAT est compris entre 0,9 et 2,0 g/l
Le résultat du dosage d’AAT peut être interprété comme suit : une concentration sérique inférieure à la valeur normale (1,1 g/L) définit un déficit qui peut être léger (entre 0,9 g/L et 1,1 g/L), intermédiaire (0,57 g/L à 0,9 g/L) ou sévère (<0,57 g/L). Néanmoins, une concentration d'alpha-1-antitrypsine dans le sang de 0,57 g/L est définie comme un seuil protecteur contre le risque de développer des manifestations pulmonaires de la maladie 1.
On considère qu’un patient est déficitaire lorsque son taux d’alpha-1 antitrypsine est inférieur à cette valeur de 0,5 g/L. Les patients PiSZ et PiZZ sont donc les plus à risque de développer un emphysème pulmonaire.
Une maladie génétique fréquente mais sous-diagnostiquée 1,4,5
Dans le monde, au moins 116 millions d’individus ont un phénotype (ou combinaison allélique) PiMS ou PiMZ, et 3,4 millions ont un phénotype PiSS, PiSZ ou PiZZ.
Selon les dernières recommandations françaises de la SPLF de 2022 (Société de Pneumologie de Langue Française) , on peut estimer qu'il y a en France 10 000 individus PiZZ, 100 000 individus PiSZ et 1 500 000 PiMZ, potentiellement à risque de développer une maladie des poumons ou du foie.
Des études de dépistage ont estimé que moins de 10 % des patients déficitaires étaient diagnostiqués.
De plus, le diagnostic du DAAT est souvent posé de façon tardive, plus de 5 ans après l'apparition des premiers symptômes respiratoires.
•
Ce sous-diagnostic peut s’expliquer par plusieurs facteurs
Une concentration faible en AAT n’est pas toujours associée à la survenue de manifestations,
Le déficit en AAT n’est souvent évoqué que devant certaines situations d’emphysème sévère ou survenant chez le sujet jeune ou non-fumeur (une minorité des cas).
- J.-F. Mornex et al. Atteinte pulmonaire du déficit en alpha-1-antitrypsine. Recommandations pratiques pour le diagnostic et la prise en charge. Revue des maladies respiratoires. Vol 39, Issue 7, Septembre 2022, p633-656.
- Balduyck M, et al. Diagnosis of alpha-1 antitrypsin deficiency: modalities, indications and diagnosis strategy. Rev Mal Respir. 2014 Oct;31(8):729-45
- Silverman EK, Sandhaus RA. Clinical practice. Alpha1-antitrypsin deficiency. N Engl J Med. 2009 Jun 25;360(26):2749-57.
- Brode S et al. Alpha-1 antitrypsin deficiency: a commonly overlooked cause of lung disease. Can. Med. Assoc. J. 2012 Sept 184(12):1365-1371
- De Serres FJ. Worldwide racial and ethnic distribution of alpha1-antitrypsin deficiency: summary of an analysis of published genetic epidemiologic surveys. Chest. 2002 Nov;122(5):1818-29.
- Cuvelier A. Le déficit en alpha-1 antitrypsine. Rev Mal Resp. 2007 24:7-17